|
 تعلم أن الماء يتكون من تفاعل الهيدروجين والأوكسجين والمعادلة التالية تلخص
ما يحدث:
تعلم أن الماء يتكون من تفاعل الهيدروجين والأوكسجين والمعادلة التالية تلخص
ما يحدث:
|
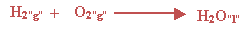 |
|
 وبناء على قانون حفظ المادة ولأغراض إجراء
الحسابات علينا أن نزن هذه المعادلة:
وبناء على قانون حفظ المادة ولأغراض إجراء
الحسابات علينا أن نزن هذه المعادلة: |
|
 |
ما المعاني التي تحملها هذه المعادلة الموزونة وكيف نستفيد منها في إجراء
الحسابات الوزنية ؟ تعني هذه المعادلة :
يمكننا
أن نحول بسهولة من مولات إلى غرامات فوزن المول من ذرات الهيدروجين =
i1i
غم , إذن وزن مول من
H2
=
ii2
= 2×1ii
غم , ووزن المول من
ذرات
O
=
i16iغم,
إذن وزن المول من
O2
=
i32i
= i16
× 2i
غم. أما وزن المول من
H2O
فهو i18ii
= i16
+
2
غم
وعلى ذلك يمكن أن
نكتب:
|
وزن المواد الناتجة |
وزن المواد المتفاعلة |
|
وزن
i2i
مول من الماء
H2Oii |
وزن
i2iمول
من
iH2i
+ وزن
i1iمول
منiO2i |
|
i2i×
i18i |
i32i×
i1i+
i2i×
i2i |
|
i36i
غم |
i36i
= i32
+
4
غم |
 سؤال:إذا تفاعل
i2iغم
من الهيدروجين مع كمية كافية من الأوكسجين, فما وزن الماء الناتج ؟؟
سؤال:إذا تفاعل
i2iغم
من الهيدروجين مع كمية كافية من الأوكسجين, فما وزن الماء الناتج ؟؟
 كم
مولاً من الماء ينتج عن تفاعل
i7.5
مولاً من O2
( الأوكسجين ) مع كمية زائدة من الهيدروجين ؟
كم
مولاً من الماء ينتج عن تفاعل
i7.5
مولاً من O2
( الأوكسجين ) مع كمية زائدة من الهيدروجين ؟
لماذا استعملنا عبارة
" كمية زائدة " في
السؤال ؟
 إذا
تفاعلت كمية من الأوكسجين مع كمية زائدة من الهيدروجين ونتج عن ذلك
5.4
غم من الماء , فالمطلوب:
إذا
تفاعلت كمية من الأوكسجين مع كمية زائدة من الهيدروجين ونتج عن ذلك
5.4
غم من الماء , فالمطلوب:
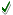 حساب عدد مولات O2؟
حساب عدد مولات O2؟
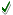 حساب وزن O2
بالغرامات؟
حساب وزن O2
بالغرامات؟
|
 يحضر الأوكسجين مخبرياً من تحلل كلورات البوتاسيوم حسب المعادلة
:
يحضر الأوكسجين مخبرياً من تحلل كلورات البوتاسيوم حسب المعادلة
: |
|
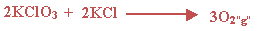 |
إذا
حللنا
ii0.1
مول من KClO3
فما مقدار الأوكسجين الذي ينتج مقاساً :
|
 بالجزيئات
بالجزيئات |
 بالغرامات
بالغرامات |
 بالمولات
بالمولات |
 بسبب ذوبان كلوريد الكالسيوم في الماء صفات غير مرغوب فيها سواء في الاستعمال
المنزلي أو الصناعي ,وإحدى طرق التخلص منه تتم بإضافة كربونات الصوديوم حسب
المعادلة :
بسبب ذوبان كلوريد الكالسيوم في الماء صفات غير مرغوب فيها سواء في الاستعمال
المنزلي أو الصناعي ,وإحدى طرق التخلص منه تتم بإضافة كربونات الصوديوم حسب
المعادلة :
|
 |
|
فإذا
كان الماء الموجود في خزان يحوي 1.11 كغم من كلوريد الكالسيوم الذائب ,
فاحسب كتلة كربونات الصوديوم اللازمة لتخليص الماء من الكلوريد الذائب
فيه ؟؟ |
اضغط هنا لمعرفة الإجابة
|

