|
 من المعادلة الموزونة نفهم أنه كلما تفاعل
i2i
مول من
H2
ينتج
i2i مول من الماء, إذن يمكن أن نستنتج أنه إذا تفاعل مول واحد من
H2 واحد من
H2O.
والآن لنعد إلى سؤالنا : كم مولاً من
H2 موجودة في
i2i
غم هيدروجين؟
من المعادلة الموزونة نفهم أنه كلما تفاعل
i2i
مول من
H2
ينتج
i2i مول من الماء, إذن يمكن أن نستنتج أنه إذا تفاعل مول واحد من
H2 واحد من
H2O.
والآن لنعد إلى سؤالنا : كم مولاً من
H2 موجودة في
i2i
غم هيدروجين؟
وزن المول من
H2
ه
=
i2i=
i1i
×
i2i
غم.
إذن
i2i غم هيدروجين هي عبارة عن مول واحد, وعندما يتفاعل مول واحد من
الهيدروجين ينتج مول واحد من الماء.
وزن المول من الماء = (i16i
×i1i
) + (i1i
×i2i
)
=
i2iغم
+
i16i
غم
=
i18i
غم
إذن عند تفاعل 2 غم هيدروجين مع الأوكسجين ينتج
i18i
غم ماء.
 تدريب
(1): اقترح طرقاً أخرى للحل.
تدريب
(1): اقترح طرقاً أخرى للحل.
 استعملنا عبارة
" كمية زائدة "
لنؤكد على أنه يوجد كمية من الهيدروجين تسمح باستهلاك كل كمية الأوكسجين
المتفاعلة وهي
i7.5i
مولاً.
استعملنا عبارة
" كمية زائدة "
لنؤكد على أنه يوجد كمية من الهيدروجين تسمح باستهلاك كل كمية الأوكسجين
المتفاعلة وهي
i7.5i
مولاً.
من المعادلة نفهم أنه كلما تفاعل مول واحد من الأوكسجين , ينتج
i2i
مول من الماء. كم عدد مولات الماء الناتجة إذن ؟
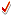 الجواب : عدد مولات الماء =
i2i × عدد مولات الأوكسجين.
الجواب : عدد مولات الماء =
i2i × عدد مولات الأوكسجين.
= i15i
=
i7.5i
×
i2i
مولاً من الماء.
 تحليل السؤال (51):
تحليل السؤال (51):
|
المعادلة الموزنة
 |
|
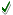 من المعادلة كل مول من
O2
(i32i)
غم ينتج مولين من الماء (
i36iغم)
.
من المعادلة كل مول من
O2
(i32i)
غم ينتج مولين من الماء (
i36iغم)
.
 كم عدد مولات الماء المعطاة في السؤال ؟
كم عدد مولات الماء المعطاة في السؤال ؟ |
|
 |
 تدريب : جرب بنفسك أن تجد طرقاً أخرى للحل.
تدريب : جرب بنفسك أن تجد طرقاً أخرى للحل.
 تحليل السؤال (52):
تحليل السؤال (52):
|
الجواب |
السؤال |
|
يتحلل مولان من
KClO3
وينتج
i3i
مولات من
O2. |
 ما
العلاقة بين مولات
KClO3
ومولات
O2
كما تفهمها من المعادلة الموزونة؟
ما
العلاقة بين مولات
KClO3
ومولات
O2
كما تفهمها من المعادلة الموزونة؟
|
|
i0.1i
مول |
 كم عدد مولات
KClO3
التي تحللت حسب ما ورد في السؤال
؟
كم عدد مولات
KClO3
التي تحللت حسب ما ورد في السؤال
؟ |
|
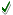 كيف تحسب عدد مولات
O2
التي تنتج عن تحلل
i0.1i
مول من
KClO3
؟
كيف تحسب عدد مولات
O2
التي تنتج عن تحلل
i0.1i
مول من
KClO3
؟
 |
|
i32i=
i16i×
i2i
غم |
 كم وزن المول من
O2
؟
كم وزن المول من
O2
؟ |
|
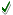 i4.8i=
i32i×
i0.15i
غم
i4.8i=
i32i×
i0.15i
غم
( وهو المطلوب (ب) في السؤال). |
 كم وزن
i0.15iمول
من
O2
؟
كم وزن
i0.15iمول
من
O2
؟ |
|
 كم عدد
الجزيئات الحقيقية الموجودة في مول من
O2؟
كم عدد
الجزيئات الحقيقية الموجودة في مول من
O2؟
يوجد عدد أفوجادرو ما الجزيئات وهو
i2310i×i6.023i
جزيء في
مول واحد من
O2. |
|
 إذن كم عدد جزيئات
O2
الموجودة في
0.15
مولاً؟
إذن كم عدد جزيئات
O2
الموجودة في
0.15
مولاً؟
الجواب : عدد الجزيئات =
i2310i
×
i6.023i
×i0.15i
= i2310×
i0.90345i
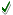 = i2210i
× i9.0i
جزيء ( وهو المطلوب (ج) في السؤال . = i2210i
× i9.0i
جزيء ( وهو المطلوب (ج) في السؤال .
|
 حتى تتمكن من حل السؤال
عليك أن تجيب عن الأسئلة التالية:
حتى تتمكن من حل السؤال
عليك أن تجيب عن الأسئلة التالية:
 كم مولاً من كربونات الصوديوم تلزم للتخلص من مول واحد من كلوريد
الكالسيوم؟
كم مولاً من كربونات الصوديوم تلزم للتخلص من مول واحد من كلوريد
الكالسيوم؟
 كم وزن المول من كلوريد الكالسيوم؟
كم وزن المول من كلوريد الكالسيوم؟
 كم وزن المول من كربونات الصوديوم؟
كم وزن المول من كربونات الصوديوم؟
 كم وزن
iCaCli2
الموجود في الخزان بالغرامات؟
كم وزن
iCaCli2
الموجود في الخزان بالغرامات؟
 يتفاعل مول واحد من كلوريد الكالسيوم (
i111i
غم) مع مول واحد من كربونات الصوديوم (
i106i
غم) , بناءً على هذا كم غراماً من كربونات الصوديوم تلزم للتفاعل مع
i1110i
غم من كلوريد الكالسيوم؟
يتفاعل مول واحد من كلوريد الكالسيوم (
i111i
غم) مع مول واحد من كربونات الصوديوم (
i106i
غم) , بناءً على هذا كم غراماً من كربونات الصوديوم تلزم للتفاعل مع
i1110i
غم من كلوريد الكالسيوم؟
قم بإجراء العملية الحسابية واستخرج كتلة كربونات الصوديوم اللازمة.
رجوع
|

