|
 سؤال
:
سؤال
:
إذا كان لديك محلول حمض
HA
تركيزه ( 0.1 مول / لتر ) وأن نسبة تفكك ( تأين ) الحمض 1.7% . احسب ما يلي :
أ-
احسب
[
+H3O
]
ب-
احسب
PH
ج- احسب
Ka
للحمض
HA
د- إذا علمت أن الكتلة المولية للحمض ( 40 غم / مول ) فكم غراماً يجب إذابتها
من هذا الحمض في ( 100 مل ) من الماء للحصول على المحلول المذكور .
 الجواب :
الجواب :
|
 |
|
1.7% = [
+H3O
]
ه×
100%
[
+H3O
]
=ه1.7 × 0.1
=ه1.7 ×
10-3
مول / لتر |
| |
|
ب-
PH
= - لو [
+H3O
]
=
- لو 1.7 × 10-3 = 2.77 |
| |
 |
ج- |
| |
صفر |
صفر |
0.1 |
| |
+ س |
+ س |
- س |
| |
+ س
|
+ س |
0.1 - س |
|
|
|
|
 |
| |
|
[-A
]
= [
+H3O ]
=ه1.7 ×
10-3 مول / لتر |
|
|
|
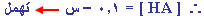 |
| |
|
[
HA
]
=ه0.1 مول / لتر |
| |
|
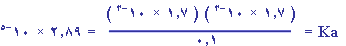 |
| |
|
 |
|
ك الحمض = ت × كم × ح لتر
= 0.1 × 40 × 0.1 = 0.4 غم |

اكتبوا لنا ملاحظاتكم واستفساراتكم
|
تحرير :
المدرسة
العربية www.schoolarabia.net |
اعداد :
أحمد الحسين
أ . سليم حمام |
|
|
تاريخ التحديث : 18
حزيران 2002 |
| |
|
|

