|
 قانون التخفيف
قانون التخفيف
ان عدد
مولات المذاب لا يتغير بتخفيف المحلول ، الا أن حجمه وتركيزه يتغيران بالتخفيف.
عدد مولات المذاب قبل التخفيف = عدد مولات المذاب بعد
التخفيف
( التركيز × الحجم ) قبل التتخفيف = ( التركيز × الحجم ) بعد التخفيف
ح1 × ت1 = ح2 × ت2
ويسمى هذا
القانون بقانون التخفيف .
وللتطبيق على هذا القانون انظر الى التطبيق
الآتي :
اذا اردت تحضير محلول مخفف من حمض الكبريتيك حجمه 250 مل وتركيزه 1,8 مول/لتر ،
وكان لديك محلولا ً مركزا ً من الحمض ويبلغ تركيزه 18 مول/لتر . فكم يلزمك من
حجم الحمض المركز لتحضير محلول الحمض المخفف المطلوب ؟
الجواب :
ح1 = حجم المحلول المركز .
ت1 = تركيز المحلول المركز = 18 مول/لتر .
ح2 = حجم المحلول المخفف = 250 مل .
ت2 = تركيز المحلول المخفف = 1,8 مول/لتر .
|
ح1 × ت1 = ح2 ×
ت2
ح1 × 18 مول/لتر = 250 مل × 1.8 مول/لتر
ح2 = 25 مل . |
|
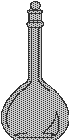 |
ولتحضير هذا المحلول نأخذ 25 مل من المحلول المركز بوساطة ماصه ونضعه في دورق
حجمي سعته 250 مل ، ونكمل الحجم بالماء
المقطر . |
 تدريب :
تدريب :
احتاج طالب الى محلول من هيدروكسيد الصوديوم
حجمه 200 مل وتركيزه 0.2 مول/لتر ، وكان لديه محلولاً آخر من هيدروكسيد الصوديوم
تركيزه 4 مول/لتر . كم مللترا ً من المحلول المركز يلزم لتحضير المحلول المطلوب
؟

اكتبوا لنا ملاحظاتكم واستفساراتكم
|
تحرير :
المدرسة
العربية www.schoolarabia.net |
اعداد :
أحمد الحسين
أ . سليم حمام |
|
|
تاريخ التحديث : 18
حزيران 2002 |
| |
|
|

